Reticulado cristalino
Todos os metais, incluindo-se neste caso o ferro puro, possuem o que se convenciona chamar de estrutura cristalina. Para que possamos entender do que se trata vamos considerar uma rede de pontos que se prolonga infinitamente nas três direções do espaço. Se todas as retas que formam a rede estiverem regularmente espaçadas em cada uma das direções, os pontos de intersecção estarão também regularmente espaçados e neste caso fica caracterizada uma rede espacial de pontos.
A geometria da rede espacial fica perfeitamente caracterizada se utilizarmos três vetores para defini-la. Assim, se tomarmos por base o comprimento dos três vetores como sendo a, b e c e se tomarmos o ângulo ente estes mesmos vetores como sendo a, teremos o que se convenciona chamar de constante de rede. Estas constantes nos permitem definir exatamente como os pontos se distribuem no espaço, pois, se repetirmos o comprimento de um vetor, por exemplo a, segundo a direção dada por a, encontraremos uma nova interseção, ou seja um outro ponto de rede. Similarmente se combinarmos a distância b com o ângulo a e a distância c com o ângulo a encontraremos pontos a cada repetição. Devemos entender, ainda, que em um enfoque puramente geométrico, tanto as distâncias quanto os ângulos podem ter o mesmo valor ou serem diferentes entre si, o que nos permitiria uma série de combinações. Indo um pouco adiante, poderíamos associar a esta rede espacial uma série de átomos distribuídos regularmente pelo espaço, não necessariamente localizados nos pontos de intersecção, mas respeitando a regularidade determinada pelas distâncias e pelos vetores. Desta forma teríamos caracterizada uma estrutura cristalina, que nada mais é do que uma rede de pontos regularmente espaçados com uma distribuição regular dos átomos. Muitos materiais possuem uma distribuição característica e regular dos seus átomos sendo chamados então de materiais cristalinos. Como existe esta regularidade, uma estrutura cristalina de um material não precisa ser representada por todos os seus átomos mas apenas por um conjunto de átomos que possam definir a sua distribuição no espaço. Este conjunto de átomos deve ser escolhido de tal forma que uma vez repetidas as suas posições nas três direções do espaço tenhamos a representação de toda a estrutura cristalina do material. A esta pequena porção do reticulado cristalino que tem a propriedade de representar todo o cristal chamamos célula unitária. Uma célula unitária terá sempre associada uma figura geométrica ( as distâncias a, b e c e os vetores a,b e g) e a distribuição característica dos átomos. No estudo das estruturas cristalinas são utilizadas apenas sete figuras geométricas, caracterizando sete sistemas cristalinos e estes produzem um total de apenas quatorze distribuições características dos átomos, produzindo quatorze estruturas cristalinas. Embora alguns materiais possam apresentar distribuições mais complexas, apenas estas quatorze células unitárias são suficientes para permitir o estudo dos materiais cristalinos.
Dentre os sistemas apresentados os que mais interessam para o estudo dos tratamentos térmicos de aços são o sistema cúbico e o sistema tetragonal. Por uma questão de simplicidade os átomos em um reticulado cristalino são representados como esferas perfeitas mas isto não implica em diferenças muito grandes em relação ao caso real. Como exemplo temos as estruturas cubica simples, cubica de corpo centrado, cubica de faces centradas e tetragonal de corpo centrado.
Se olharmos mais atentamente para estas figuras podemos retirar outros valores que são úteis para comparação entre as várias estruturas. Os parâmetros característicos mais utilizados são as medidas características dos vetores, chamado parâmetro de rede, o número de átomos por célula unitária, o número de vizinhos que cada átomo possui (átomos que distam entre si dois raios atômicos), chamado número de coordenação e a relação entre o volume ocupado pelos átomos e o volume da célula unitária, chamado de fator de empacotamento. Para que se possa entender um pouco melhor estas estruturas teceremos mais algumas considerações a respeito das mesmas a seguir.
Estrutura cúbica de corpo centrado
Estrutura cubica simples. Os átomos estão localizados nos vértices. a=b=c; a=b=g=90o |
A estrutura cúbica de corpo centrado é uma estrutura que possui os seguintes parâmetros geométricos: a=b=c e a=b=g=90o. Estes valores fazem com que a célula unitária seja caracterizada pela figura de um cubo. Além disso os átomos estão localizados nos vértices e no centro da célula. Observe-se que os átomos dos vértices tem apenas um oitavo do seu volume ocupando espaço na célula unitária. Neste caso o parâmetro de rede, representado pelo lado do cubo, vale  , o número de átomos por célula unitária é 2 (um átomo correspondendo à soma dos oito oitavos dos átomos dos vértices e mais o átomo localizado no centro da célula), número de coordenação de 8 e um fator de empacotamento de 0,68, onde R é o raio atômico. Deve ser lembrado que, embora estes parâmetros tenham sido retirados da célula unitária, eles são válidos para toda a estrutura cristalina. Isto significa que, independente da célula unitária escolhida e do átomo tomado como referência, devemos encontrar sempre os mesmos valores.
, o número de átomos por célula unitária é 2 (um átomo correspondendo à soma dos oito oitavos dos átomos dos vértices e mais o átomo localizado no centro da célula), número de coordenação de 8 e um fator de empacotamento de 0,68, onde R é o raio atômico. Deve ser lembrado que, embora estes parâmetros tenham sido retirados da célula unitária, eles são válidos para toda a estrutura cristalina. Isto significa que, independente da célula unitária escolhida e do átomo tomado como referência, devemos encontrar sempre os mesmos valores.
Estrutura cúbica de faces centradas
Estrutura cubica de faces centradas. Os átomos estão localizados nos vértices e no centro de cada uma das faces. a=b=c; a=b=g=90o |
A estrutura cúbica de faces centradas possui os mesmos parâmetros geométricos que a estrutura cúbica de corpo centrado, porém, a distribuição dos átomos é um pouco diferente. Neste caso existem átomos localizados nos vértices e no centro de cada uma da faces do cubo. Isto faz com que os átomos das faces tenham apenas metade do seu volume ocupando espaço na célula unitária. O parâmetro de rede vale  , o número de átomos por célula unitária é 4 (um átomo correspondendo à soma dos oito oitavos dos átomos dos vértices e mais três átomos correspondentes aos átomos localizados nas faces), número de coordenação de 12 e um fator de empacotamento de 0,74. Comparando-se o fator de empacotamento das duas estruturas pode-se ver que a estrutura CFC é mais compacta do que a estrutura CCC, isto é, os seus átomos ocupam de maneira mais eficiente o espaço. Se considerarmos o mesmo raio atômico, pode-se dizer que os átomos organizados segundo uma estrutura CFC ocuparão menor volume o que conduzirá a uma maior densidade.
, o número de átomos por célula unitária é 4 (um átomo correspondendo à soma dos oito oitavos dos átomos dos vértices e mais três átomos correspondentes aos átomos localizados nas faces), número de coordenação de 12 e um fator de empacotamento de 0,74. Comparando-se o fator de empacotamento das duas estruturas pode-se ver que a estrutura CFC é mais compacta do que a estrutura CCC, isto é, os seus átomos ocupam de maneira mais eficiente o espaço. Se considerarmos o mesmo raio atômico, pode-se dizer que os átomos organizados segundo uma estrutura CFC ocuparão menor volume o que conduzirá a uma maior densidade.
Interstícios
Em qualquer estrutura cristalina o fator de empacotamento é sempre menor do que um, isto é, os átomos não ocupam todo o espaço disponível na célula unitária. Este fato implica em que existam espaços vazios entre os átomos da estrutura. Estes espaços vazios recebem o nome de interstícios e exercem um papel muito importante nos tratamentos térmicos dos aços como será visto mais adiante. Normalmente existem vários interstícios em uma estrutura cristalina e quanto menor o fator de empacotamento maior é o volume destinado aos interstícios, embora o tamanho de cada um dependa do raio atômico e da estrutura cristalina. Deste modo uma estrutura CFC possui interstícios maiores do que uma estrutura CCC, embora o seu fator de empacotamento seja maior. A principal conseqüência disto é que, quando se tiver uma solução em que os átomos do soluto se colocam em posições intersticiais, como é o caso da liga ferro-carbono, a estrutura que tiver os maiores interstícios apresentará uma maior solubilidade do que aquela que possui interstícios menores.
Um interstício sempre é denominado pela figura poliédrica formada pelos átomos que estão em volta do espaço vazio e desta forma vamos encontrar interstícios tetraédricos e insterstícios octaédricos. Tanto a estrutura CCC quanto a estrutura CFC possuem estes interstícios, no entanto estes são maiores na estrutura CFC.Índices de Miller
 |
| Direções cristalinas em uma estrutura cúbica (Van Vlack) |
A disposição característica dos átomos na estrutura cristalina de um material faz com que existam direções e planos característicos para cada estrutura. Estas direções e planos tornam-se importantes pelo fato de influírem no comportamento do material como é o caso da deformação. Sempre que tivermos deformação esta se dará segundo determinadas direções e planos particulares para cada estrutura. Isto se deve principalmente ao fato de que existe uma maior densidade de átomos em determinadas direções gerando planos de escorregamento quando ocorre deformação plástica. Para a determinação exata das direções e planos foi criada uma notação apropriada que é chamada de índices de Miller.
 |
Planos cristalinos em uma estrutura cúbica (Avner) Plano Azul (110) Plano Verde (010) |
Os índices de uma direção estão relacionados com as coordenadas de um ponto com relação à origem do sistema de eixos. Assim, a direção [100] corresponde a um vetor paralelo ao eixo x, enquanto que a direção [010] corresponde a um vetor paralelo ao eixo y. No caso dos planos, os índices correspondem ao inverso do valor das interseções do plano com os eixos. Deste modo um plano (100) corresponde a um plano paralelo aos eixos y e z enquanto que um plano (010) corresponde a um plano paralelo aos eixos x e z.
Defeitos na estrutura cristalina
Embora até aqui tenhamos representado uma estrutura cristalina como uma rede de pontos que se distribui regularmente pelo espaço com átomos a ela associados e também regularmente distribuídos, isto não acontece nos materiais cristalinos reais. Todos os materiais cristalinos possuem um certo número de defeitos os quais podem influir decisivamente em suas propriedades. Abaixo relacionaremos alguns dos principais defeitos para que se tenha idéia de como os mesmos se apresentam no reticulado cristalino.
a- Lacunas
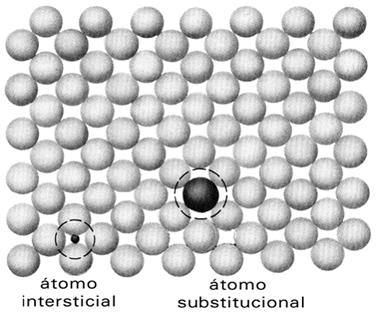
Este defeito é caracterizado pela ausência de um átomo em uma posição que deveria ser ocupada na estrutura cristalina. Isto gera uma deficiência de ligações entre os átomos fazendo com que os mesmos tendam a se aproximar, o que provoca uma distorção na rede e produz um acúmulo de energia naquele ponto.
Caracteriza-se pela presença de um átomo em um interstício da estrutura cristalina. Neste caso o átomo pode ser do próprio elemento que forma a estrutura, sendo chamado de defeito auto-intersticial, ou por um átomo estranho, chamado defeito de impureza intersticial. Pelo fato dos interstícios em uma estrutura serem pequenos com relação aos átomos que abrigam, um defeito intersticial produz uma distorção e um acúmulo de energia muito maior do que uma lacuna.
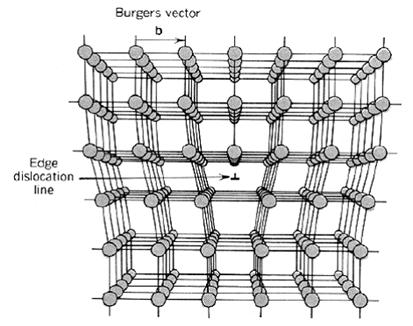
Uma discordância é um defeito planar que envolve o posicionamento de uma série de átomos. O caso mais comum deste tipo de defeito é o que é chamado dediscordância em cunha. Neste caso uma discordância em cunha pode ser vista como um plano extra de átomos, produzindo um efeito de cunha no reticulado. Por envolver um grande número de átomos uma discordância envolve um acúmulo de energia muito maior do que um defeito de lacuna ou intersticial.
As discordâncias exercem um papel muito importante na deformação plástica pois são elas que permitem o escorregamento de planos cristalinos que produzem a deformação. Se a discordância estiver livre para se deslocar pelo reticulado cristalino a deformação se produz facilmente, ao passo que se existirem defeitos como os intersticiais ou a presença de precipitados, o deslocamento será dificultado restringindo a deformação. Isto irá se refletir em um aumento do limite de escoamento do metal.
Em um material real, não temos uma estrutura cristalina com uma única orientação. Se observarmos a orientação da estrutura de um material veremos que ela é subdividida em um grande número de zonas, cada uma delas com uma orientação diferente, isto é, cada uma das zonas forma um cristal independente. A estes cristais que possuem uma orientação particular chamamos de grãos. Todos os grãos de uma mesma fase do material possuem a mesma estrutura cristalina, diferindo somente na orientação. A conseqüência desta orientação diferente é que na fronteira entre os grãos existe uma zona de transição entre duas orientações e, por isso, os átomos que fazem parte desta fronteira estão mal organizados e com um nível mais alto de energia. A esta região chamamos de contorno de grão.
O contorno de grão exerce um papel importante nas transformações de fase, onde a maior energia dos átomos favorece a nucleação, e na deformação plástica, onde tem a função de restringir o movimento das discordâncias.
Estrutura do ferro puro
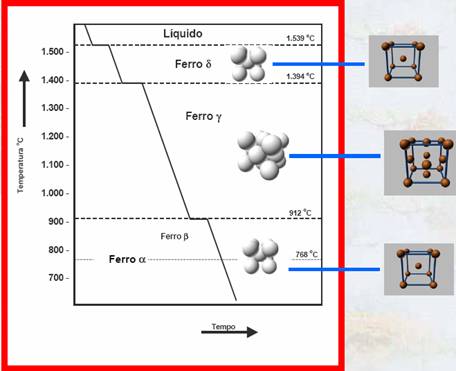 |
(Fonte: ESTRUTURA E PROPRIEDADES DOS MATERIAIS - ESTRUTURA CRISTALINA Prof. Rubens Caram – UNICAMP) |
Alotropia é a propriedade que têm certos materiais de mudarem de estrutura cristalina dependendo da temperatura em que estiverem. O ferro puro possui esta propriedade, podendo ter os seus átomos organizados em uma estrutura CCC ou em uma estrutura CFC. Desde a temperatura ambiente até 912 C o ferro apresenta uma estrutura cristalina CCC e nestas condições é chamado de ferro . De 912 C até 1394 C apresenta estrutura CFC e é chamado de ferro . Finalmente de 1394 C até o ponto de fusão a 1538 C volta a apresentar estrutura CCC, sendo chamado de ferro . Estas alterações na estrutura cristalina produzem uma série de implicações tanto nas transformações do ferro puro quanto nas ligas de ferro. Por exemplo, anteriormente foi citado que a estrutura CCC tem um fator de empacotamento de 0,68 enquanto que uma estrutura CFC tem um fator de empacotamento 0,74. Quando o ferro passa de CCC para CFC a 912 C, esta diferença no fator de empacotamento provoca uma redução no volume e um aumento na densidade.
Solução do carbono no ferro
A aplicação mais importante da transformação alotrópica do ferro se encontra nas ligas ferro-carbono. O carbono forma uma solução sólida intersticial com o ferro, isto é, os átomos de carbono se colocam nos interstícios da estrutura cristalina do ferro. A conseqüência prática deste tipo de solução é que teremos uma liga de baixo custo e com possibilidades de uma grande variação nas propriedades dependendo do teor de carbono e do tratamento térmico utilizado.
Observando os interstícios tetraédricos e octaédricos que ocorrem nas estruturas CCC e CFC. Estes interstícios variam de tamanho de acordo com a estrutura, isto é, os interstícios da estrutura CCC são menores do que os da estrutura CFC. Isto significa que de acordo com o tamanho do interstício teremos um menor ou maior espaço disponível para que um átomo de uma solução intersticial venha se colocar naquela posição. Como os átomos que entram em solução são sempre maiores do que os interstícios, cada átomo intersticial produzirá uma certa quantidade de distorção do reticulado cristalino e quanto menor for o interstício maior será a distorção. No caso da estrutura CCC os raios atômicos máximos possíveis para que não haja distorção correspondem a 0,29R para os interstícios tetraédricos e 0,15R para os interstícios octaédricos, onde R é o raio atômico do átomo que forma a estrutura. Na estrutura CFC estes valores correspondem a 0,23R para os interstícios tetraédricos e 0,41R para os interstícios octaédricos.
No caso da liga ferro-carbono estes valores correspondem a 0,36 ângstrons e 0,19 ângstrons para a estrutura CCC, onde o raio atômico do fero é 1,24 ângstrons, e 0,29 ângstrons e 0,52 ângstrons para a estrutura CFC, onde o raio atômico do ferro é 1,27 ângstrons. Como o raio atômico do carbono é de aproximadamente 0,77 ângstrons é fácil notar que em qualquer situação teremos uma distorção do reticulado sempre que um átomo de carbono se colocar em um interstício. Quando se forma a solução ferro-carbono os átomos de carbono irão se alojar nos interstícios octaédricos, pois estes propiciam uma melhor acomodação, o que implica em uma menor energia de distorção.
Do acima exposto pode-se entender facilmente que deverá haver uma menor solubilidade do carbono no ferro do que no ferro . No caso do ferro a solubilidade máxima do carbono é de aproximadamente 0,025% em peso ou 0,1% em número de átomos, na temperatura de 727 C, enquanto que no ferro a solubilidade máxima é de 2,1% em peso ou 9% em número de átomos, na temperatura de 1148 C.
Ferro:
Propriedades Mecânicas:
Um metal maleável, tenaz, de coloração cinza prateado apresentando propriedades magnéticas; é ferromagnéticoa temperatura ambiente, assim como o Níquel e o Cobalto.
.
Propriedades físicas | |
Estado da matéria | sólido , (ferromagnético) |
Ponto de fusão | 1811 K (1538 °C) |
Ponto de ebulição | 3134 K (2861 °C) |
Volume molar | 7,09 ×10-6 m3/mol |
Entalpia de vaporização | 349,6 kJ/mol |
Entalpia de fusão | 13,8 kJ/mol |
Pressão de vapor | 7,05 Pa A 1808 K |
Velocidade do som | 4910 m/s at 293,15 K |
.

 RSS Feed
RSS Feed Twitter
Twitter Facebook
Facebook Sobre
Sobre Contato
Contato


1 comentários:
Qual a importância do conhecimento das estruturas cristalinas em empresas que trabalham com metais?
Postar um comentário
REGRAS PARA COMENTÁRIOS
► Comentários pejorativos ou que agridam outros leitores são excluídos
► É expressamente proibido qualquer forma de propaganda não autorizada. Seja ela sobre outros blogs, comunidade no orkut ou sites.
Por isso, antes de fazer qualquer tipo de divulgação, contate-nos primeiro.
► Os comentários devem ter relação com o conteúdo postado.
Em caso de dúvida, entre em contato conosco.
O Blog da Mecânica agradece a compreensão.
att adm